Реакции ионного обмена
Введение
На этой странице показана общая концепция равновесия ионного обмена, коэффициенты селективности и типичные реакции различных типов ионообменных смол.
Равновесие
Когда ионообменная смола в ионной форме A контактирует с раствором, содержащим ион B, наблюдается равновесная реакция. Вот пример катионного обмена:
R-A+ + B+  R-B+ + A+
R-B+ + A+
В процессе ионного обмена ионы A будут мигрировать в раствор и замещаться ионами B из раствора до достижения равновесия. Это равновесие описывается законом действующих масс следующим образом:
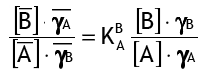
где [..] обозначает концентрации, γ — коэффициенты активности, а черта указывает на фазу смолы. K — это коэффициент селективности B+ по отношению к A+ для реакции ионного обмена:
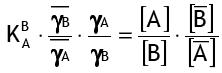
В первом приближении коэффициенты активности считаются постоянными, так что упрощённый коэффициент селективности равен:
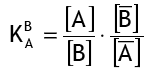
Для наиболее распространённой реакции между сильнокислотной смолой в H+ форме и ионами натрия (Na+) в воде уравнение (1) принимает вид:
R-H+ + Na+ 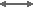 R-Na+ + H+
R-Na+ + H+
И соответствующий коэффициент селективности равен
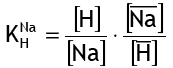
Значение коэффициента K(Na/H) составляет около 1,7 для стандартной сульфоновой сильнокислотной обменной смолы гелевого типа (см. таблицу коэффициентов селективности). Это означает, что если смолу с известным составом ионов Na и H поместить в чистую воду, ионы натрия будут мигрировать в воду до тех пор, пока концентрация натрия не достигнет равновесия, определяемого уравнением (6).
Для двухвалентных ионов, например (реакция умягчения):
2 R-Na+ + Ca++ 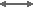 R2-Ca++ + 2 Na+
R2-Ca++ + 2 Na+
Коэффициент селективности равен:
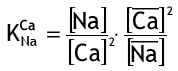
Регенерация
Регенерация состоит в обращении равновесия путём увеличения концентрации иона, вытесняемого в равновесной реакции. Например, умягчитель регенерируется с использованием высокой концентрации ионов [Na+] в правой части реакции (7). Это приводит к смещению реакции влево.
Колонная работа
В обычной практике ионного обмена смола не остаётся в равновесии с раствором. Вместо этого раствор отводится на выходе из колонны, так что равновесие постоянно смещается вправо. Посмотрите снова на уравнение (1):
R-A+ + B+  R-B+ + A+
R-B+ + A+
Обработанный раствор — обогащённый ионами A+ и обеднённый ионами B+ — уносится и замещается необработанным раствором, в котором концентрация ионов A+ низкая, а [B+] высокая. Это позволяет смоле удалять больше ионов B+ из раствора, потому что равновесие смещается вправо.
Теперь рассмотрим специфическое поведение распространённых ионообменных смол.
Сильнокислотные смолы
Когда смола изначально находится в водородной форме H+ (R-SO3–H+, сокращённо здесь R-H), она может удалять все катионы из раствора:
R-H + Na+Cl–  R-Na + H+Cl–
R-Na + H+Cl–
Второй пример с бикарбонатом кальция:
2 R-H + Ca++(HCO3–)2  R2-Ca + 2 H2CO3
R2-Ca + 2 H2CO3
Здесь реакция является нейтрализацией, так как бикарбонат-анион щелочной. Она необратима, поскольку невозможно регенерировать СКК смолу угольной кислотой.
Реакции (9) и (10) являются обычными на первом этапе обессоливания. Смотрите декатионирование.
Когда смола изначально находится в натриевой форме Na+, СКК смолы удаляют двухвалентные катионы из воды, но не другие одновалентные катионы, потому что разница в селективности с K+ или NH4+, например, слишком мала.
2 R-Na + Ca++(HCO3–)2  R2-Ca + 2 Na+HCO3–
R2-Ca + 2 Na+HCO3–
Эта реакция умягчения обратима, но вы не стали бы регенерировать бикарбонатом натрия из-за риска осаждения карбоната кальция. Вместо этого используется хлорид натрия.
Слабокислотные смолы
Они реагируют по-другому, так как они лишь слабо ионизированы в регенерированной (H+) форме. С нейтральными солями реакция не наблюдается:
R-COOH + Na+Cl–  ничего
ничего
Вот объяснение: предполагая, что реакция произойдёт, она создаст HCl как продукт. Но поскольку смола — более слабая кислота, чем соляная кислота (продукт), смола немедленно вернётся в свою кислотную форму.
Чтобы слабокислотная смола прореагировала, она должна быть диссоциирована. Поэтому ион H+ в кислоте должен быть отнят щёлочью. Например, следующая реакция немедленна и необратима:
R-COOH + Na+OH–  R-COO–Na+ + H+OH–
R-COO–Na+ + H+OH–
Это реакция нейтрализации, продуктом которой является вода (отсюда необратимость).
В следующей реакции:
2 R-COOH + Ca++(HCO3–)2 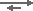 (R-COO–)2Ca++ + 2 [H+HCO3–]
(R-COO–)2Ca++ + 2 [H+HCO3–]
бикарбонат-ион «отрывает» H от карбоксильной группы, так что она становится ионизированной. Слабокислотные катионообменные смолы используются в водоподготовке для удаления бикарбонатной жёсткости из воды. Это процесс декарбонизации. Смотрите образующийся комплекс на странице структура смол. С бикарбонатом натрия вместо бикарбоната кальция или магния реакция тоже происходит, но СлКК смола имеет гораздо меньшее сродство к одновалентным ионам, так что рабочая ёмкость низкая:
R-COOH + Na+HCO3– 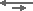 R-COO–Na+ + H+HCO3–
R-COO–Na+ + H+HCO3–
После преобразования в Na+ форму двухвалентные ионы могут обмениваться даже в отсутствие щелочных анионов:
2 R-COO–Na+ + Ca+Cl–2  (R-COO–)2Ca++ + 2 Na+Cl–
(R-COO–)2Ca++ + 2 Na+Cl–
Умягчение с помощью СлКК смолы очень эффективно благодаря высокой селективности этих смол к ионам жёсткости. Остаточная жёсткость в обработанной воде очень низкая, так что процесс, описанный реакцией (16), используется для умягчения воды при высоком фоновом содержании натрия. На практике СлКК смола преобразуется в Na+ форму с использованием кальцинированной соды (Na2CO3) или каустической соды (NaOH) перед использованием для умягчения.
Выводы: при обычном использовании (H-цикл, регенерация HCl) СлКК смола удаляет только жёсткость, и только при наличии щёлочности; для умягчения (Na-цикл) СлКК смолу сначала нужно преобразовать в Na-форму щёлочью.
Сильноосновные смолы
Когда смола изначально находится в гидроксидной форме OH– (R-CH2-N(CH3)3+OH–), сокращённо здесь R-OH), она может удалять все анионы из раствора:
R-OH + Na+Cl– 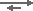 R-Cl + Na+OH–
R-Cl + Na+OH–
Регенерация СОА смол осуществляется обращением реакции (17) относительно концентрированным раствором каустической соды.
После катионного обмена [реакция (9)] реакция имеет вид:
R-OH + H+Cl–  R-Cl + H+OH–
R-Cl + H+OH–
Это реакция нейтрализации сильной кислоты, продуктом которой является вода. Поэтому она необратима.
СОА смола в OH– форме также обменивает слабые кислоты, такие как угольная кислота:
R-OH + H+HCO3–  R-HCO3 + H+OH–
R-HCO3 + H+OH–
Вторая реакция происходит, пока на смоле есть ионы OH–:
R-HCO3 + H+HCO3–  R2-CO3 + H+OH–
R2-CO3 + H+OH–
Карбонат-ионы располагаются на двух функциональных группах смолы. Обратите внимание, что на практике смолы в OH– форме не используются для удаления бикарбоната или карбоната из нейтральной воды, когда она содержит жёсткость, из-за опасности осаждения гидроксида или карбоната кальция.
Смола также реагирует с очень слабыми кислотами, такими как кремниевая кислота (SiO2) или борная кислота (H3BO3). В следующей реакции кремниевая кислота представлена как H2SiO3:
R-OH + H+HSiO3–  R-HSiO3 + H+OH–
R-HSiO3 + H+OH–
Когда СОА смола изначально находится в хлоридной форме Cl–, она может обменивать любые анионы, к которым имеет более высокую селективность (см. таблицу селективности):
R-Cl + NO3– 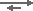 R-NO3 + Cl–
R-NO3 + Cl–
Реакция (21) представляет процесс удаления нитратов, для которого используются специальные СОА смолы с различными функциональными группами с повышенной селективностью к нитратам.
Слабоосновные смолы
Наиболее распространённая функциональная группа — R-CH2-N(CH3)2. Эти смолы не ионизированы в регенерированной форме свободного основания. Поэтому они не реагируют с нейтральными солями:
R-CH2-N(CH3)2 + Na+Cl–  ничего
ничего
Чтобы СлОА смолы прореагировали, они должны сначала быть ионизированы. Только сильная кислота может протонировать амин, который превращается в четвертичный аммоний. Во многих случаях реакция происходит после декатионирования воды или обрабатываемого раствора (9):
R-CH2-N(CH3)2 + H+Cl–  R-CH2-NH+(CH3)2+Cl–
R-CH2-NH+(CH3)2+Cl–
Поглощение всего соединения соляной кислоты преобразует СлОА смолу в её солянокислую (.HCl) форму. Аналогичные реакции происходят с сульфатом и нитратом после катионного обмена.
Однако щёлочность СлОА смолы недостаточно сильна, чтобы протонировать активную группу слабыми кислотами, так что эти смолы не могут удалять кремний или углекислый газ из воды:
R-CH2-N(CH3)2 + H+HCO3–  ничего
ничего
Слабоосновные смолы используются для удаления только сильных кислот, но они имеют более высокую ёмкость и легче регенерируются, чем СОА смолы.
Хелатные смолы
Эти смолы с несколькими различными функциональными группами (см. примеры типов селективных смол) способны образовывать комплексы с металлами. Смотрите также пример комплекса на странице структура смол.
Дополнительная информация
- Селективность (общая информация).
- Таблицы селективности для катионообменных и анионообменных смол.
- Процессы водоподготовки для практического применения вышеуказанных реакций.
- Применения ионного обмена (водоподготовка и многие другие области).
- Различные типы смол с примерами.
- Структура ионообменных смол в целом.
Оригинал: © François de Dardel
Перевод на русский язык: VACO Engineering, 2026
vaco-eng.ru