Детали анализа воды
Введение
Эта страница охватывает анализ воды, необходимый для ионообменных применений. Он значительно проще, чем анализ, который вы бы использовали для оценки качества питьевой воды.
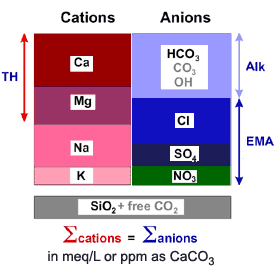 Общие характеристики исходной воды описаны на другой странице с рекомендуемыми пределами для определённых загрязнителей и параметров. Здесь мы сосредоточимся на неорганических компонентах, растворённых в воде.
Общие характеристики исходной воды описаны на другой странице с рекомендуемыми пределами для определённых загрязнителей и параметров. Здесь мы сосредоточимся на неорганических компонентах, растворённых в воде.
На рисунке (кликните для увеличения) показаны только компоненты, обычно встречающиеся в поверхностной или глубинной скважинной воде и важные для процессов ионного обмена.
Некоторые компоненты традиционно группируются:
| Ca++ + Mg++ | = ОЖ |
| HCO3– + CO3= + OH– | = Щ |
| Cl– + SO4= + NO3– | = ЭМК |
- Кальций и магний составляют Общую Жёсткость (ОЖ).
- Бикарбонат, карбонат и гидроксид составляют Общую Щёлочность (Щ). Обычно природная вода не содержит карбонат или гидроксид.
- Хлорид, сульфат и нитрат составляют Эквивалент Минеральной Кислотности (ЭМК), также называемый Соли Сильных Кислот (ССК) или, после катионного обмена, Свободная Минеральная Кислотность (СМК).
- Когда жёсткость больше щёлочности (в мэкв/л), бикарбонатная жёсткость называется «временная жёсткость» (= ОЖ – Щ), а оставшаяся жёсткость называется «постоянная жёсткость». Значение временной жёсткости тогда равно щёлочности в мэкв/л.
- Когда жёсткость меньше щёлочности (в мэкв/л), постоянной жёсткости нет, и временная жёсткость равна общей жёсткости.
- Все природные воды ионно сбалансированы, т.е. сумма катионов в мэкв/л равна сумме анионов.
Другие ионы, обычно присутствующие в следовых количествах, но иногда не полностью пренебрежимые, могут быть объединены с вышеуказанными:
- барий (Ba++) и стронций (Sr++) являются щёлочноземельными металлами (см. важное примечание ниже) и относятся таким образом к жёсткости;
- для расчёта с помощью программного обеспечения ионного обмена вы также добавляете двухвалентное железо (Fe++), никель (Ni++) и медь (Cu++) в группу жёсткости для удобства;
- аммоний (NH4+) и калий (K+) обрабатываются как натрий;
- литий (Li+) также реагирует как натрий (Na+);
- фосфат (PO43–) относится к ЭМК;
- фторид (F–), бромид (Br–) и йодид (I–) являются галогенидами и ведут себя как хлорид.
Имейте в виду, что стандартные смолы могут иметь плохое сродство к некоторым из этих ионов, таким как Li и F. Кроме того, другие возможные компоненты, такие как алюминий, мышьяк и многие другие металлы, могут быть комплексированы и вести себя как анионы, и иногда их удаление затруднено.
Специфическое поведение бария и стронция:
- Растворимость сульфата бария составляет всего 2 мг/л, в тысячу раз меньше, чем сульфата кальция.
- Ba и Sr плохо удаляются на СлКК смолах. Эти смолы имеют более низкое сродство к Ba и Sr, чем к Ca и Mg. Смотрите таблицу значений селективности.
- Ba (и Ra) очень хорошо удаляются на СКК смолах. Настолько хорошо, что регенерация может быть затруднена. Использование H2SO4 для регенерации СКК смолы, загруженной — даже частично — барием, может быть практически невозможным.
Смотрите также (несвязанную) информацию о морской воде.
Единицы концентрации и ёмкости
Поскольку нам нужно знать количество ионов, подлежащих обмену — их масса здесь не помогает — концентрация всех этих ионов должна быть преобразована в химические «эквивалентные» единицы, международной единицей которых является экв·кг–1, которую мы традиционно переименовываем в эквиваленты на литр экв/л, и в случае низких концентраций — мэкв/л. Другие единицы концентрации всё ещё используются регионально:
| Название | Сокращение | мэкв/л | |
|---|---|---|---|
| ppm в пересчёте на карбонат кальция | 1 ppm as CaCO3 | = | 0,02 |
| Французский градус | 1 °f | = | 0,2 |
| Немецкий градус жёсткости | 1 °dH | = | 0,357 |
| Гран как CaCO3 на галлон США | 1 gr as CaCO3/gal | = | 0,342 |
| Название | Сокращение | экв/л | |
|---|---|---|---|
| Грамм как CaCO3 на литр | 1 г as CaCO3/л | = | 0,02 |
| Французский градус | 1 °f | = | 0,0002 |
| Грамм как CaO на литр | г CaO/л | = | 0,0357 |
| кгр как CaCO3 на кубический фут | kgr CaCO3/ft3 | = | 0,0458 |
Полные таблицы пересчёта можно увидеть в отдельном окне.
Единицы моль следует избегать в ионном обмене, так как она не учитывает валентность и приносит только путаницу. Для справки: 1 экв = 1 моль / валентность.
Для любопытных: моль содержит 6,02×1023 атомов, ионов или молекул. Это большое число называется постоянная Авогадро.
Примечание: в Германии и некоторых других странах Центральной и Восточной Европы используются mval/л и val/л вместо мэкв/л и экв/л.
Примеры
В таблице показаны наиболее распространённые ионы в воде и их эквивалентная масса.
| Название | Ион | г/моль | г/экв |
|---|---|---|---|
| Кальций | Ca++ | 40 | 20 |
| Магний | Mg++ | 24 | 12 |
| Натрий | Na+ | 23 | 23 |
| Калий | K+ | 39 | 39 |
| Аммоний | NH4+ | 18 | 18 |
| Хлорид | Cl– | 35,5 | 35,5 |
| Сульфат | SO4= | 96 | 48 |
| Нитрат | NO3– | 62 | 62 |
| Бикарбонат | HCO3– | 61 | 61 |
| Карбонат | CO3= | 60 | 30 |
В воде концентрации выражаются в мэкв/л. Например, если у вас концентрация кальция 90 мг/л, эквивалентная концентрация составляет 90/20=4,5 мэкв/л.
Кремний (SiO2), не ионизированный в обычной воде, имеет молярную массу 60. Для ионного обмена (с сильноосновной смолой в OH-форме) он считается одновалентным, так что эквивалентная масса тоже 60.
Углекислый газ (CO2) очень слабо ионизирован в обычной воде и также считается одновалентным, с молярной и эквивалентной массой 44. Равновесие между CO2 и HCO3 показано внизу этой страницы.
Не путайте: 1 эквивалент CaCO3 (50 г), например, содержит 1 экв Ca (20 г) и 1 экв CO3 (30 г). Вы не складываете их (один экв катиона и один экв аниона): это всё ещё только 1 экв CaCO3, не 2!
Сбалансированный анализ?
Вода электрически нейтральна, даже когда содержит большие количества ионов. Это означает, что число анионных зарядов точно такое же, как катионных. Иначе вы бы получили удар током, опустив руку в воду. Поэтому, после того как вы тщательно преобразовали все элементы анализа воды в единицы мэкв/л, сумма анионов должна быть такой же, как сумма катионов. Единственные исключения из этого правила:
- Небольшая разница из-за неточности аналитических процедур допустима, пока разница между общим количеством катионов и анионов составляет менее 3 %.
- При высоком pH (> 8,2), например, в присутствии аммиака или после известкового декарбонизирования, будут присутствовать гидроксидные или карбонатные ионы. Гидроксидные ионы обычно не указываются отдельно. Карбонатные ионы не всегда указываются. В таком случае у вас будет больше катионов, чем анионов.
- При низком pH (скажем, < 6,8) вода может содержать либо свободную минеральную кислотность (очень редко для природной воды), либо свободный углекислый газ, оба производят ионы H, которые обычно не указываются отдельно.
Пример анализа воды
Вот анализ, необходимый для расчёта ионообменной установки (умягчение, обессоливание, декарбонизация, удаление нитратов). Это реальная вода (1), из реки Уаза, во Франции, датированная 28 сентября 2005 года.
| Катионы | мг/л | мэкв/л | Анионы | мг/л | мэкв/л |
| Ca++ | 93 | 4,65 | Cl– | 67 | 1,89 |
| Mg++ | 12 | 1,00 | SO4= | 33 | 0,69 |
| Na+ | 26 | 1,13 | NO3– | 6 | 0,10 |
| K+ | 4 | 0,10 | HCO3– | 259 | 4,23 |
| Всего катионов | 6,90 | Всего анионов | 6,91 | ||
| SiO2 | 2,4 | 0,04 | |||
| Значение pH | 7,04 | Свободный CO2 | 45 | 1,02 | |
| Электропроводность мкСм/см | 627 | Анионная нагрузка | 7,97 | ||
| Органика (2) | 2,6 | ||||
| Температура °C | 16 | ||||
(2) Органика (ХПК) важна, потому что может загрязнять анионообменные смолы. Обычно выражается в мг/л в пересчёте на KMnO4.
Этот конкретный анализ типичен для Западной Европы, с относительно высокой жёсткостью и щёлочностью, и малым содержанием кремния. Кремний и свободный углекислый газ удаляются сильноосновной анионной смолой в системе обессоливания. Однако углекислый газ может быть снижен дегазатором после катионного обмена для уменьшения анионной нагрузки.
m- и p-Щёлочность
Щёлочность включает следующие анионы:
- Гидрокарбонат HCO3–, часто называемый бикарбонат
- Карбонат CO3=
- Гидроксид OH–
- Фенолфталеин, меняющий цвет при pH 8,3, измеряет p-щёлочность
- Метилоранж, меняющий цвет при pH 4,5, измеряет m-щёлочность
HCO3– + OH–  CO3= + H2O
CO3= + H2O
Таким образом, с увеличением pH у вас будет либо только бикарбонат, либо бикарбонат + карбонат, либо только карбонат, либо карбонат + гидроксид, либо только гидроксид. Это даёт следующую таблицу, из которой можно рассчитать компоненты щёлочности:
| Ион | p = 0 | p < m/2 | p = m/2 | m/2 < p < m | p = m | |
| OH | = | 0 | 0 | 0 | 2 p - m | p |
| CO3 | = | 0 | 2 p | m = 2 p | 2 (m - p) | 0 |
| HCO3 | = | m | m - 2 p | 0 | 0 | 0 |
Значения в таблице выражены в эквивалентных единицах, т.е. в мэкв/л, ppm CaCO3, французских или немецких градусах, не в моль/л или мг/л!
Рассмотрим примеры со значениями в мэкв/л, с водами возрастающего pH
| Пример 1 | m-Щ = 5 | p-Щ = 0 |
|---|---|---|
| OH = 0 | CO3 = 0 | HCO3 = 5 |
| Пример 2 | m-Щ = 5 | p-Щ = 1,5 |
| OH = 0 | CO3 = 3 | HCO3 = 2 |
| Пример 3 | m-Щ = 5 | p-Щ = 3 |
| OH = 1 | CO3 = 4 | HCO3 = 0 |
Если p-Щёлочность > 0, что означает значение pH более 8,3, у вас нет свободного CO2, потому что он соединился бы с CO3 с образованием HCO3.
CO2 + CO3= + H2O  2 HCO3–
2 HCO3–
Свободный CO2 и pH
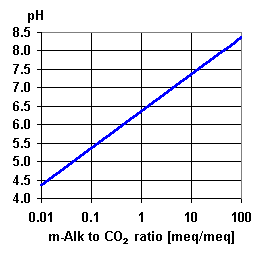 Низкое значение pH означает, что в растворе есть ионы H+. В присутствии бикарбоната существует следующее равновесие:
Низкое значение pH означает, что в растворе есть ионы H+. В присутствии бикарбоната существует следующее равновесие:
H+ + HCO3–  H2CO3
H2CO3  CO2 + H2O
CO2 + H2O
Два рисунка иллюстрируют это равновесие. Используйте второй график, чтобы проверить, что анализ воды, предоставленный вашим заказчиком, имеет смысл, и чтобы оценить концентрацию свободного углекислого газа, если она не указана. Вы также видите там, что при pH более 7,2 эта концентрация практически пренебрежима.
При обработке пермеата обратного осмоса, однако, эта зависимость очень важна, так как CO2 составляет наибольшую часть анионной нагрузки на смолу. В этом случае вы можете использовать третий график, который является крупным планом другого для низких концентраций.
Оригинал: © François de Dardel
Перевод на русский язык: VACO Engineering, 2026
vaco-eng.ru