Обменная ёмкость ионообменных смол
Введение
Ионный обмен — это циклический процесс: ионы загружаются на смолу, смола постепенно истощается, и когда места для загрузки новых ионов не остаётся, фаза загрузки прерывается, и смолу необходимо регенерировать.
Обменная ёмкость показывает количество ионов, загруженных на смолу.
Определения
Полная ёмкость
Полная ёмкость образца смолы — это количество ионообменных центров. Подробности см. в конце страницы. Типичные значения ёмкости приведены ниже.
Другими словами, полная ёмкость — это максимальное теоретическое количество ионов, которое смола может загрузить.
Рабочая ёмкость
Также называется полезной ёмкостью. Это количество ионообменных центров, где обмен действительно произошёл за время рабочего цикла. Это также число зарядов смолы (не число ионов, поскольку некоторые ионы имеют более одного заряда), поглощённых смолой за один цикл.
Другими словами, рабочая ёмкость — это фактическое количество ионов, загруженных на смолу между регенерациями. Она зависит от нескольких параметров.
Обменная ёмкость выражается в экв/л (эквивалентах на литр смолы).
Единицы моль следует избегать в ионном обмене, поскольку она не учитывает валентность и вносит путаницу. Для справки: 1 экв = 1 моль / валентность.
Рабочая ёмкость всегда меньше полной ёмкости. Далее мы рассмотрим почему.
Зона обмена
Идеальный случай
 Начало цикла |
 Середина цикла |
 Конец цикла |
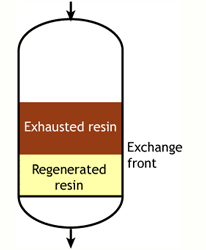
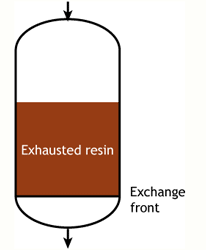
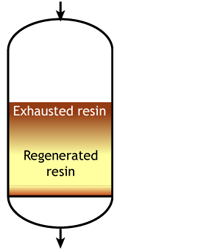
В идеальном случае мы бы начинали с полностью регенерированной смолы. Во время рабочего цикла фронт обмена был бы абсолютно плоским, то есть каждый бесконечно тонкий слой смолы мгновенно переходил бы из регенерированного состояния в истощённое, захватывая поступающие ионы с бесконечной скоростью обмена. Этот плоский фронт двигался бы вниз по колонне по мере удаления ионов из воды. В какой-то момент плоский фронт достиг бы дна колонны, и смола была бы полностью истощена. В таком случае рабочая ёмкость была бы равна полной ёмкости смолы. На практике такого случая не существует, поскольку фронт обмена не плоский, и смола не всегда полностью регенерирована в начале цикла.
В реальности существуют два случая:
Случай 1: смола полностью регенерирована в начале цикла (слабокислотные и слабоосновные)
 Начало цикла |
 Середина цикла |
 Конец цикла |
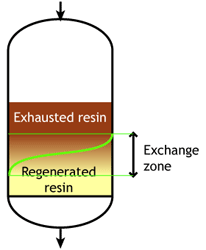
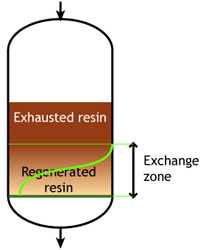
В начале цикла смола полностью регенерирована. В ходе рабочего цикла верхние слои загрузки постепенно истощаются. Однако реакция обмена не бесконечно быстрая, поскольку ионы должны найти путь к доступным центрам внутри каждой гранулы смолы. Поэтому некоторые ионы проникают на нижние уровни загрузки прежде, чем вышележащие слои полностью истощены. Область между полностью регенерированной и полностью истощённой смолой называется зоной обмена или зоной реакции, как показано на рисунках.
На определённом этапе ионы начинают «проскакивать» в очищенную воду. Рабочий цикл останавливается, когда концентрация этого проскока ионов достигает заданного значения. Это называется конечной точкой цикла. На этом этапе ионообменная смола не полностью истощена, поэтому рабочая ёмкость меньше полной ёмкости.
Рабочая ёмкость, как определено выше, — это разница между истощённой смолой в начале и в конце цикла. Показанное здесь поведение типично для слабокислотных и слабоосновных ионообменных смол, которые могут быть полностью регенерированы минимальным количеством регенеранта, близким к стехиометрическому значению. Стехиометрическое количество регенеранта — это количество химических эквивалентов, точно равное ионной нагрузке за цикл обмена. На практике слабые смолы регенерируются с небольшим избытком сверх стехиометрического количества.
Типичная рабочая ёмкость слабоосновного анионита составляет 70–90% от полной ёмкости. Для слабокислотного катионита рабочая ёмкость зависит от нескольких параметров, поэтому простой оценки не существует. Однако слабокислотные катиониты, имея высокую полную ёмкость и регенерируясь почти стехиометрически, т.е. без избытка (см. расход регенеранта), очень полезны для вод с высокой концентрацией щёлочности и жёсткости.
Случай 2: смола частично истощена в начале цикла (сильнокислотные и сильноосновные)
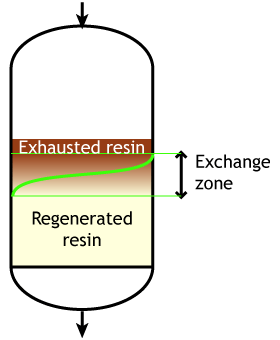 Начало цикла |
 Середина цикла |
 Конец цикла |
Этот второй случай типичен для сильнокислотных и сильноосновных смол, которые труднее регенерировать, поэтому через слой смолы необходимо пропускать избыток регенерирующего химиката. Даже при этом полная регенерация смолы экономически нецелесообразна (потребовалась бы очень высокая дозировка регенеранта), поэтому на практике слой смолы регенерируется лишь частично. На рисунках показан слой смолы с нисходящей загрузкой и восходящей регенерацией. См. страницу о деталях регенерации.
Типичная рабочая ёмкость сильнокислотных и сильноосновных смол составляет 40–60% от их полной ёмкости.
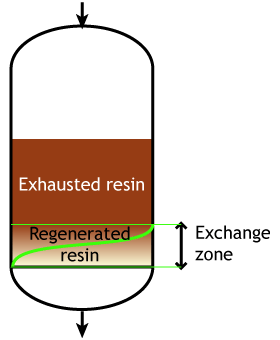
Случай 2б: смолы с прямоточной регенерацией
 Начало цикла |
 Середина цикла |
 Конец цикла |
Исходная вода во время рабочего цикла и регенерационный раствор движутся сверху вниз. В результате верхние слои загрузки смолы хорошо регенерированы в начале цикла, а нижние — нет. Во время рабочего цикла часть ионов из исходной воды, не удалённых при регенерации, проскакивает в очищенную воду, как показано на странице о регенерации.
Например, если смола регенерируется кислотой, часть ионов H+, выделившихся при удалении ионов Na+ из исходной воды, продвигается вниз по колонне и вытесняет некоторые ионы Na+, оставшиеся внизу после предыдущей регенерации. Проскок натрия при этом значительно выше, чем при противоточной регенерации.
Кинетика ионного обмена
Слабокислотные и слабоосновные смолы чувствительны к скорости потока. При увеличении скорости потока зона реакции становится длиннее.
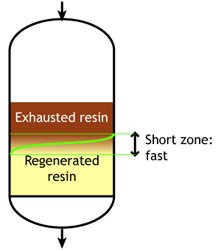 Низкая скорость потока: зона реакции короткая |
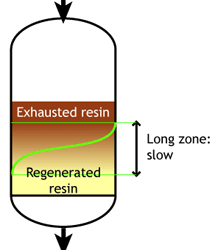 Высокая скорость потока: зона реакции длинная |
Когда зона реакции короткая, достижимая рабочая ёмкость выше, поскольку большая доля полной ёмкости может быть использована до достижения конечной точки проскока.
Сильнокислотные и сильноосновные смолы менее чувствительны к скорости потока.
Мелкозернистые смолы обычно имеют более высокую кинетику; это особенно справедливо для слабокислотных и слабоосновных смол. Причина — более короткий путь для ионов внутри гранул смолы.
Параметры, влияющие на рабочую ёмкость
 Рабочая ёмкость зависит от ряда технологических переменных, включая:
Рабочая ёмкость зависит от ряда технологических переменных, включая:
- Концентрацию и тип ионов, подлежащих адсорбции
- Скорость потока при работе
- Температуру
- Тип, концентрацию и количество регенеранта
- Тип процесса регенерации (прямоточная, противоточная...)
- Высоту слоя (только для противоточной регенерации)
- Размер частиц ионообменных смол
Измерение полной ёмкости
Полная ёмкость образца смолы измеряется титрованием и выражается в экв/л. Процедура включает измерение объёма и должна проводиться в строгих условиях. Поскольку объём изменяется в зависимости от ионной формы смолы (некоторые ионы имеют большую массу и их объём отличается от других), ионная форма измерения должна всегда указываться.
Полная ёмкость также должна указываться как ёмкость по сухому весу после высушивания образца смолы. Ёмкость по сухому весу измеряет количество активных групп на кг сухой смолы, т.е. без влагосодержания. Она выражается в экв/кг. Указание ионной формы здесь также критически важно, поскольку разные ионы имеют разную массу.
Ёмкость по сухому весу важна для двух целей:
- Для новых смол она даёт информацию об эффективности процесса активации: например, если каждое ароматическое кольцо было сульфировано в сильнокислотной смоле, теоретическая максимальная полная ёмкость по сухому весу составляет около 5,5 экв/кг в H+-форме.
- Для отработанных смол она даёт информацию о возможном загрязнении (фаулинге): загрязнённый образец смолы содержит посторонние вещества, которые увеличивают сухой вес, и в результате ёмкость по сухому весу (число активных групп на кг сухого вещества) уменьшается, даже если ни одна функциональная группа не была потеряна.
Рабочая ёмкость на практике
Мы видели, что рабочая ёмкость ионообменной смолы — это доля от полной ёмкости. Она также выражается в экв/л (эквивалентах на литр смолы) и показывает количество ионов (точнее, число зарядов), которое может быть обменено за один цикл.
В следующей таблице приведены типичные значения полной и рабочей ёмкости для распространённых смол (все значения в экв/л, наиболее распространённое значение в скобках):
| Тип смолы* | Полная ёмкость | Рабочая ёмкость |
|---|---|---|
| СлКК (WAC) | 3,7–4,5 [4,2] | 1,0–3,5 |
| СКК (SAC) | 1,7–2,2 [2,0] | 0,6–1,7 |
| СлОА (WBA) | 1,1–1,7 [1,3] | 0,8–1,3 |
| СОА (SBA) | 0,9–1,4 [1,2] | 0,4–0,9 |
Рассмотрим, например, сильнокислотный катионит (СКК), используемый для умягчения, и предположим, что жёсткость обрабатываемой воды составляет 4,4 мэкв/л, а смола в конкретных условиях эксплуатации имеет рабочую ёмкость 1,1 экв/л, что равно 1100 мэкв/л.
Каждый литр ионообменной смолы сможет обработать 1100 / 4,4 = 250 литров жёсткой воды до необходимости регенерации. На жаргоне ионного обмена это означает, что производительность составляет 250 объёмов загрузки. Если жёсткость воды выше, производительность будет меньше, и наоборот. См. также единицы измерения концентрации и ёмкости.
Экспериментальный расчёт рабочей ёмкости
Пример умягчения
У вас есть ионообменная колонна, содержащая объём V (литров) катионита СКК(Na). Обрабатываемая вода содержит концентрацию жёсткости C, выраженную в мэкв/л. Для измерения и расчёта рабочей ёмкости необходимо непрерывно измерять остаточную жёсткость на выходе из колонны или отбирать пробу каждые несколько минут (скажем, 5–15 мин) и анализировать её жёсткость. Построение графика отдельных значений остаточной жёсткости должно дать следующую красную кривую.
Цикл останавливается, когда остаточная жёсткость достигает конечного значения. К этому моменту произведён объём Q умягчённой воды. Количество R ионов жёсткости, удалённых смолой, составляет (в мэкв):
R = Q × C
И рабочая ёмкость вашей колонны:
Ёмкость = Q × C / V (мэкв/л)
Пример: ваша колонна содержит V = 2000 л смолы (Amberjet 1000 Na), исходная вода содержит C = 6 мэкв/л жёсткости, производительность Q составляет 360 м³ = 360 000 л, тогда рабочая ёмкость колонны:
Ёмкость = (360 000 × 6) / 2000 = 1080 мэкв/л = 1,08 экв/л
Точно такой же расчёт применим к колонне для удаления нитратов с использованием нитрат-селективного анионита, где вместо жёсткости используется концентрация нитратов.
Профили производительности при обессоливании
Здесь ситуация сложнее, поскольку имеется как минимум два типа смол (катионит и анионит), а иногда три или четыре (слабые и сильные). Если у вас только две смолы, профиль катионита аналогичен приведённому выше графику, но в качестве контрольного параметра вместо жёсткости используется электропроводность (после анионитовой колонны). Для расчёта ёмкости катионита потребуется общая концентрация катионов в исходной воде, а для анионита — концентрация анионов после дегазатора (если есть), с обязательным добавлением кремнезёма и свободного CO2 к анионам.
Слабокислотный катионит (СлКК)
- В начале цикла смола выделяет некоторое количество свободной минеральной кислотности. Это выглядит так, будто слабокислотная смола имеет сильнокислотные группы, хотя это не так. Проскок свободной минеральной кислотности через некоторое время исчезает и заменяется проскоком щёлочности.
- Этот проскок щёлочности определяет конечную точку цикла. В системах декарбонизации стандартная конечная точка достигается, когда проскок щёлочности составляет 10% от щёлочности исходной воды.
- При обессоливании, когда слабокислотный катионит сочетается с сильнокислотным, нет необходимости (и, собственно, невозможно в случае систем Stratabed или многокамерных Amberpack) контролировать качество на выходе слабокислотного катионита: важен только проскок натрия на выходе сильнокислотного катионита (см. следующий раздел).
Сильнокислотный катионит (СКК)
- Значение pH на выходе из ёмкости с сильнокислотным катионитом низкое (2–4), пока смола имеет доступную ёмкость, т.е. когда она выделяет ионы H+. Когда смола приближается к истощению, выделяется меньше ионов H+, и значение pH возрастает.
- Профиль свободной минеральной кислотности симметричен профилю pH: во время рабочего цикла смола выделяет свободные минеральные кислоты; в момент проскока в фильтрате появляются соли натрия, т.е. кислотность уменьшается.
- Значение электропроводности на выходе сильноосновного анионита (при условии достаточной ёмкости) отражает проскок натрия из сильнокислотного катионита: оно остаётся низким, пока ионы натрия не появятся на выходе катионитовой колонны.
- На выходе катионитовой колонны, используемой для обессоливания, не должно быть измеримой жёсткости. Наличие жёсткости указывало бы на серьёзную проблему регенерации, или каналообразование в слое смолы, или осаждение сульфата кальция, если смола регенерируется серной кислотой.
Слабоосновный анионит (СлОА)
- Слабоосновная смола поглощает свободные минеральные кислоты. Поэтому значение pH относительно высокое в начале цикла. Если вода дегазирована (дегазатор перед слабоосновным анионитом), значение pH выше, в противном случае угольная кислота в обработанной воде немного его снижает.
- Электропроводность обычно составляет 5–20 мкСм/см, несколько выше при наличии больших количеств CO2. При проскоке соляной кислоты электропроводность снова возрастает.
- В установках с комбинацией слабоосновного и сильноосновного анионитов нет необходимости отслеживать профиль слабоосновного анионита. Фактически слабоосновная смола чаще всего перерабатывается, часть свободных минеральных кислот проходит к сильноосновному аниониту. Это всегда происходит в конструкциях Stratabed, Stratapack и многокамерных Amberpack. Качество очищенной воды контролируется на выходе сильноосновного анионита (см. следующий раздел).
Сильноосновный анионит (СОА)
- На выходе из ёмкости с сильноосновным анионитом необходимо контролировать как проскок кремнезёма, так и электропроводность. Если катионит имеет избыточную ёмкость, проскок кремнезёма произойдёт раньше проскока по электропроводности. Это нежелательно, поскольку кремнезём труднее контролировать, чем электропроводность. Поэтому анионит следует рассчитывать (на этапе проектирования) с большим запасом прочности.
- В показанном здесь случае предполагается, что имеется избыточная ёмкость катионита (нежелательный случай). На графике видно, что электропроводность немного снижается в момент проскока кремнезёма. Это связано с тем, что удельная электропроводность силиката натрия ниже, чем у гидроксида натрия.
- В этом случае, когда электропроводность снова возрастает, это означает, что проскок кремнезёма уже произошёл, т.е. в очищенной воде присутствуют большие количества кремнезёма.
- Желательный случай — когда проскок катионита происходит первым.
- Значение pH очищенной воды также показано на графике. Однако следует отметить, что измерение pH проблематично в чистой воде. Поэтому pH не следует использовать как основной параметр управления процессом. Тем не менее аномалии в значениях pH могут дать некоторые указания о том, какой тип смолы может быть причиной эксплуатационной проблемы.
Важное замечание
Испытания не следует проводить со «свежими» смолами. Несколько циклов (обычно два-три) должны быть выполнены до того, как система достигнет равновесия. Ёмкость первого цикла (называемого нулевым циклом) выше, чем в последующих циклах, поскольку в этом первом цикле смола полностью регенерирована, что не имеет места в дальнейшем.
Рекомендации по базовой лабораторной установке и условиям работы приведены здесь.