Структура ионообменных смол
Введение
Ионообменные смолы — это полимеры, к которым присоединены функциональные группы. Здесь мы рассмотрим химическую структуру матрицы смолы, функциональные группы и общий химический процесс производства ионообменных смол.Смолы производятся в несколько этапов, два основных из которых:
- Полимеризация матрицы смолы
- Функционализация: ионообменные группы присоединяются к матрице
Матрица смолы
Около 90 % всех ионообменных смол основаны на полистирольной матрице. «Строительным блоком», используемым для создания этого пластикового каркаса, является мономер стирола — ароматическое соединение, также называемое винилбензолом. Ниже приведены химические формулы: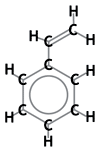 Химическая формула стирола |
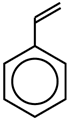 Упрощённое представление стирола |
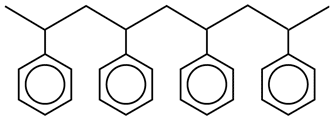
Небольшой фрагмент полистирольной цепи
Полученные линейные полимерные цепи переплетены друг с другом, но имеют малую физическую прочность: они относительно мягкие и после активации, вероятно, растворились бы в воде. Чтобы придать полимеру более стабильную трёхмерную структуру, полистирольные цепи сшиваются с другой молекулой во время полимеризации. Сшивающая молекула должна быть способна полимеризоваться на двух или трёх концах. Наиболее распространённым сшивающим агентом является дивинилбензол (сокращённо ДВБ).
Процесс полимеризации обычно проводится в суспензионной среде — либо в реакторах с перемешиванием (периодическая полимеризация), либо в специальном «струйном» оборудовании. Образующиеся полимеры представляют собой очень маленькие сферические гранулы (диаметром от 200 до 500 мкм). Струйный процесс производит гранулы очень однородного размера, тогда как периодическая полимеризация приводит к различным размерам гранул с почти гауссовым распределением частиц по размерам. Смотрите свойства смол. Эти гранулы набухают до размера 300–1200 мкм на последующих этапах функционализации и гидратации.
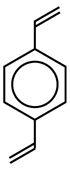 Дивинилбензол (ДВБ) |
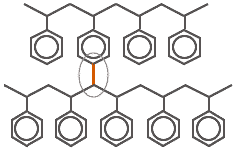 Сшитый полистирол |
Вторая связь молекулы ДВБ показана красным и присоединяется к следующей цепи линейного полистирола. Чем больше ДВБ добавляется в исходную реакционную смесь, тем более жёстким становится полимер.
Большинство ионообменных смол полимеризуются таким образом, что получаются сферические гранулы. Это может происходить либо в реакторе с перемешиванием, либо в струйном процессе. В последнем случае размер гранул очень однородный.
Гелевая и макропористая структура смол
В описанном выше процессе полимеризации сшивающий агент более или менее равномерно распределён по всей матрице. Пустоты между цепями полистирола называются порами. Они очень маленькие, их размер составляет всего несколько ангстрем, но этот размер относительно постоянен: матрица имеет псевдокристаллическую структуру, подобную стеклу, и в результате готовые гранулы ионообменной смолы прозрачные. На рисунке ниже полистирольные цепи показаны синим цветом без ароматических химических деталей, а «мостики», образованные ДВБ, показаны красным.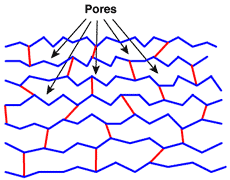
Гелевая структура
Существует предел количества ДВБ, которое можно использовать в смолах гелевого типа: слишком много ДВБ создаёт структуру с очень маленькими порами, что в конечном продукте может быть недостатком, поскольку более крупные ионы не могут проникнуть в гранулы смолы. Кроме того, высокосшитые полимеры труднее активировать.
Для преодоления этой проблемы в 1960-х годах были изобретены макропористые смолы. Идея состоит в создании искусственной пористости в трёхмерной матрице. Для этого в реакционную смесь вводится третий компонент — называемый порогеном или расширителем фазы — который не реагирует с мономерами, а только занимает место в системе. После завершения реакции полимеризации пороген вымывается и оставляет пустоты в структуре полимера. Это и есть макропоры.
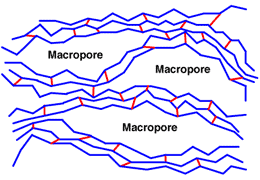
Макропористая структура
Макропористые смолы имеют двойную пористость: маленькие поры самой матрицы и большие макропоры, созданные расширителем фазы. Готовые смолы непрозрачные. Они очень стабильны, поскольку матрица обычно сильно сшита. Они также очень пористые и поэтому могут обменивать крупные ионы.
Размер пор
Функционализированные, гидратированные ионообменные смолы имеют размер пор приблизительно от 1 до 2 нм (от 10 до 20 Å), тогда как макропористые смолы, помимо своих маленьких гелевых пор, имеют макропоры размером около 20–100 нм (200–1000 Å). Для сравнения, гидратированные неорганические ионы имеют размер около 0,2–0,5 нм. Органические ионы могут быть значительно крупнее.Функционализация полимера
Описанный выше полимер должен быть активирован, чтобы превратить пластиковые гранулы в ионообменные смолы.Сильнокислотные катионообменные смолы
Активация химически проста: это реакция сульфирования. Полистирольные гранулы контактируют при высокой температуре с концентрированной серной кислотой. Продуктом является полистиролсульфонат, который является сильной кислотой.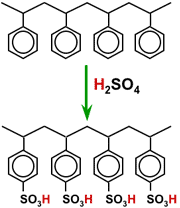
Сульфирование
После сульфирования смола промывается для удаления избытка серной кислоты. Этот этап гидратации является деликатной операцией, поскольку он вызывает набухание гранул смолы (функциональные группы гидратируются и, следовательно, увеличиваются в размерах). Соответствующая осмотическая сила значительна и может привести к разрушению гранул на части, если процесс проводится неосторожно.
Эта реакция производит смолу в водородной форме. Если продукт предназначен для использования в качестве умягчающей смолы, он должен быть преобразован на дополнительном этапе в натриевую форму. Это можно сделать, например, с помощью карбоната натрия.
Сильно- и слабоосновные анионообменные смолы
Активация более сложная, так как требует двух последовательных этапов. Кроме того, используемые химикаты более дорогие, что объясняет, почему анионообменные смолы значительно дороже, чем СКК смолы. Первый этап называется хлорметилирование и представляет собой реакцию между полимерными гранулами и хлорметилметиловым эфиром (который является очень опасным химическим веществом):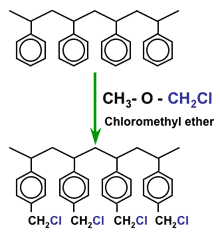
Хлорметилирование
Продукт имеет хлоридные группы, но они ковалентные, а не ионизированные. На этом этапе мы ещё не имеем анионообменной смолы. Второй этап активации — это аминирование, где ковалентный хлорид замещается амином.
Аминирование
На рисунке показаны два случая аминирования. Продуктом является четвертичная аммониевая хлоридная соль. В первой реакции используется триметиламин. По соглашению, СОА смолы, произведённые с триметиламином, называются Тип 1. Во второй реакции амин — это диметилэтаноламин, и продукт называется Тип 2. В произведённом виде СОА смолы находятся в хлоридной (Cl–) форме. Обычно они хранятся и поставляются в этой форме, которая более стабильна, чем OH– форма, и должны быть регенерированы каустической содой перед использованием в системе обессоливания.
Регенерация
Смолы типа 1 — наиболее распространённые сильноосновные обменники. Смолы типа 2 имеют более низкую основность, чем тип 1. Это приводит к лучшей регенерируемости (преобразованию в OH– форму), но смолы типа 2 более чувствительны к температурной деградации и имеют более низкую селективность к ионам, так что проскок выше при работе.
Слабоосновные анионообменные смолы производятся таким же способом, но с использованием вторичного вместо третичного амина. В большинстве случаев используется диметиламин (показан слева). Продукт — это ионообменная смола в солянокислой форме, которая регенерируется в форму свободного основания для поставки. Эта СлОА смола показана справа. В регенерированной форме СлОА смолы не имеют обмениваемых ионов. Вот почему говорят, что они находятся в форме свободного основания, а не в OH-форме, когда регенерированы. Они могут удалять только сильные кислоты из раствора, что означает, что их нужно использовать после декатионирования. Смотрите реакции ионного обмена.
 Также могут использоваться другие амины для производства специальных анионообменных смол, таких как селективные к нитратам (здесь слева триэтиламин), боратам (N-метилглюкамин, смотрите ниже) или перхлоратам.
Также могут использоваться другие амины для производства специальных анионообменных смол, таких как селективные к нитратам (здесь слева триэтиламин), боратам (N-метилглюкамин, смотрите ниже) или перхлоратам.
Слабокислотные катионообменные смолы
Эти смолы производятся не путём активации полистирольных гранул. Вместо этого они изготавливаются из акриловых полимеров, либо начиная с акрилонитрила, либо с метилакрилата.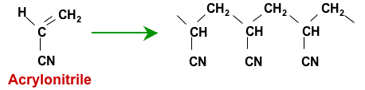
Полимеризация акрилонитрила
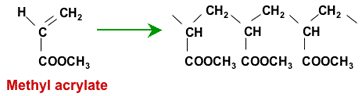
Полимеризация метилакрилата
Полученный полимер должен быть гидролизован для образования карбоксильных кислотных групп. Полиакрилонитрильный полимер гидролизуется серной кислотой, тогда как полиакрилат гидролизуется каустической содой. В обоих случаях получается одно и то же конечное соединение. Здесь показан только щелочной гидролиз:
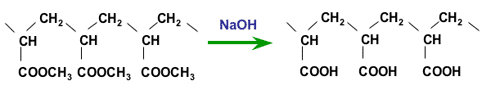
Гидролиз полиакрилата каустической содой
Полученная СлКК смола — слабая кислота, лишь частично ионизированная в нейтральной среде. Её кислотность аналогична кислотности уксусной кислоты. Благодаря алифатической (не ароматической) лёгкой структуре матрицы СлКК смолы имеют более высокую плотность активных групп, чем смолы на основе полистирола. Это приводит к высокой общей ионообменной ёмкости.
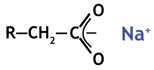
После диссоциации (с щелочным анионом, смотрите реакции) смола может обменивать катионы. Здесь пример с натрием. Образуется карбоксилатная соль.
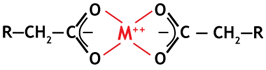
С двухвалентными металлами образуется стабильный комплекс между двумя функциональными группами, как показано слева, что объясняет высокую селективность СлКК смол к этим ионам.
Акриловые анионообменные смолы
СлОА и СОА смолы также могут быть изготовлены, начиная с акрилового вместо ароматического сополимера. Первый этап полимеризации такой же, как для СлКК смолы, начиная с метилакрилата, как показано в предыдущем разделе. Затем полиакрилат реагирует со специальным ди-амином, имеющим первичный амин на одном конце и третичный амин на другом: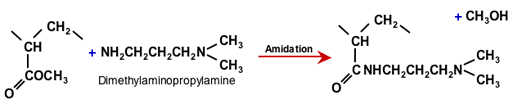
Амидирование полиакрилата с DMAPA
Полученный продукт — слабоосновная акриловая анионообменная смола. Из неё можно получить сильноосновную смолу на дополнительном этапе кватернизации с использованием метилхлорида или диметилсульфата:
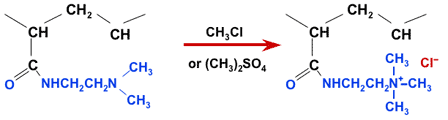
Кватернизация акриловой СлОА в СОА
Акриловые анионные смолы более гидрофильны, чем стирольные, и показывают превосходную устойчивость к органическому загрязнению.
Другие функциональные группы
Было разработано несколько других типов смол, главным образом для производства селективных смол. Ниже показаны несколько типичных активных групп:
Различные другие функциональные группы
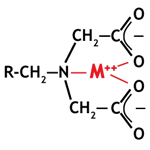 Хелатные смолы
Хелатные смолы
Большинство вышеуказанных специальных смол относятся к хелатному типу. Они способны образовывать комплексы с металлами. Их название происходит от греческого слова Χηλή, означающего «клешня», потому что ионы металлов захватываются как в клешне. На рисунке справа показан металл, комплексированный иминодиуксусной функциональной группой хелатной смолы. Хелатные смолы образуют комплексы только с многовалентными металлами. Эти комплексы очень стабильны. Поэтому эти смолы обладают высокой селективностью и способны преимущественно удалять металлы из раствора. Смотрите примеры хелатных смол на странице типы смол с соответствующими применениями.
Общее резюме наиболее распространённых смол и их активных групп показано на странице «типы смол».
Смотрите также таблицу всех известных ионообменных смол, прошлых и настоящих.
Amberlite, Ambersep, Dowex, Duolite и Imac являются торговыми марками DuPont. Lewatit — торговая марка Lanxess, Diaion — торговая марка Mitsubishi Chemicals.
Оригинал: © François de Dardel
Перевод на русский язык: VACO Engineering, 2026
vaco-eng.ru